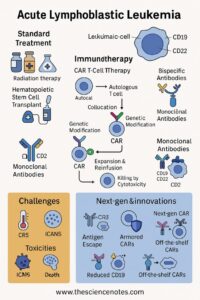
Ūminė limfoblastinė leukemija (visi) yra sparčiai progresuojanti hematologinis piktybinis navikas, kuriam būdingas nekontroliuojamas nesubrendusių limfoidinių progenitorinių ląstelių, vadinamų limfoblastų, proliferacija kaulų čiulpuose ir periferiniame kraujyje. Viskas gali atsirasti dėl B ląstelių ar T ląstelių linijų, o B-All yra vyraujantis potipis. Šis piktybinis navikas yra labiausiai paplitęs vaikų vėžys, tačiau taip pat daro įtaką suaugusiems, kai rezultatai išlieka palyginti prastesni. Visų terapinis kraštovaizdis per pastaruosius dešimtmečius dramatiškai išsivystė, patyręs chemoterapijos, tikslinių agentų, imunoterapijos ir kraujodaros kamieninių ląstelių transplantacijos pažangą, žymiai pagerinant išgyvenamumą, ypač vaikų populiacijose.
Šiame straipsnyje pateikiama išsami, moksliškai pagrįsta dabartinių visų gydymo paradigmų, molekulinių gydymo būdų ir kylančių imunoterapinių strategijų, ypač bispecifinių antikūnų, skirtų mokslininkams, klinikų gydytojams ir tyrėjams, hematologijos-onkologijos srityje, apžvalga.
1. Visų patofiziologija ir klasifikavimas
Viskas yra kloninis piktybinis navikas, atsirandantis dėl piktybinės limfoidinių progenitorinių ląstelių transformacijos, kurios normaliai nesiskiria. Limfoblastų kaupimasis pablogina normalią hematopoezę, sukeliančią kaulų čiulpų nepakankamumą, anemiją, trombocitopeniją ir imunosupresiją. Molekulinė klasifikacija padalija visus į potipius, pagrįstus linijomis (B arba T-ląsteliu) ir genetiniais anomalijomis, tokiomis kaip:
Filadelfijos chromosoma (PH+) visaapibūdinamas BCR-ABL1 suliejimo genu, atsirandančiu dėl T (9; 22) (Q34; Q11) NCI faktų lapo
MLL pertvarkė visus
ETV6-RUNX1 Fusion
Hiperdiploidija ir hipodiploidija
Panašus į pHsu kinaze aktyvinančiais pakitimais
Šie molekuliniai parašai ne tik lemia prognozę, bet ir vis labiau tiesiogiai suasmenintą terapiją.
2. Gydymo apžvalga: principai ir fazės
Svarbiausias viso gydymo tikslas yra leukeminių sprogimų panaikinimas siekiant visiško remisijos (CR), užkirsti kelią atkryčiui ir užtikrinti ilgalaikį ilgalaikį išgyvenimą be ligų. Dėl greito limfoblastų daugėjimo gydymas turi prasidėti nedelsiant po diagnozės.
Terapija pristatoma keliais etapais:
2.1 Indukcinė terapija
Pagrindinis indukcijos tikslas yra sumažinti leukemijos naštą iki nenustatyto lygio (<5% pūtimo kaulų čiulpuose), atkurti normalią kraujodaros ir periferinio kraujo kiekį. Indukcija paprastai trunka 4–6 savaites ir joje naudojama intensyvūs chemoterapijos režimai.
Už B ląstelių visistandartinė indukcija dažnai apima:
Vinkristinas: Mikrotubulų inhibitorius, sutrikęs mitozę
Kortikosteroidai (prednizonas arba deksametazonas): Limfotoksinis poveikis ir priešuždegiminės savybės
Antraciklinai (daunorubicinas arba doksorubicinas): Intercalate DNR, slopina topoizomerazę II
Asparaginazė: išeikvoja tarpląstelinį šparaginą, lemiamą leukemijos pūtimo išgyvenamumą
Už Ph+ visiindukcija apima Tirozino kinazės inhibitoriai (TKIS) tokių kaip Imatinibas arba dasatinibas TIKSLAS BCR-ABL1 FDA Imatinib patvirtinimas.
Pacientai paguldyta į ligoninę dėl naviko lizės sindromo rizikos, sunkios citopenijos ir infekcijos.
2.2 Konsolidacija/intensyvinimo terapija
Po konsolidavimo siekiama pašalinti minimalią likutinę ligą (MRD) ir užkirsti kelią atkryčiui, skiriant dideles dozes ar alternatyvius chemoterapijos derinius. Trukmė kinta, tačiau paprastai apima kelis ciklus.
MRD aptikimas srauto citometrijos arba PGR vadovų terapijos intensyvumu-pacientai, turintys aptinkamą MRD, turi blogesnę prognozę ir jiems gali būti suteiktas papildomas gydymas arba aspektas, susijęs su alogenine hematopoetinių kamieninių ląstelių transplantacija (Allo-HSCT).
2.3 Priežiūros terapija
Priežiūros terapija tęsiasi daugiau nei 2–3 metus, paprastai susideda iš kasdienio burnos 6-merkaptopurinas ir kas savaitę metotreksatassu periodiniais vinkristino ir kortikosteroidų impulsais, kad būtų palaikoma remisija.
Priežiūra yra labai svarbi siekiant išvengti atkryčio ir yra mažiau intensyvi, dažnai ambulatorinė.
2.4 Centrinės nervų sistemos (CNS) profilaktika
CNS yra bendra šventovės svetainė visiems. Profilaktinė intratekalinė chemoterapija (metotreksatas, citarabinas) reguliariai skiriamas visose gydymo fazėse. Taip pat gali būti naudojamas ir sisteminis metotreksatas. Dabar kaukolės švitinimas yra skirtas pacientams, kuriems yra akivaizdus CNS dalyvavimas ar didelė atkryčio rizika, siekiant sumažinti neurotoksiškumo NCCN gaires dėl CNS profilaktikos.
3. Hematopoetinės kamieninių ląstelių transplantacija
Alogeninė kamieninių ląstelių transplantacija (Allo-HSCT) yra atsižvelgiama į didelės rizikos pacientus, įskaitant tuos, kurie serga:
Nuolatinis MRD po konsolidacijos
Neigiamos citogenetikos (pvz., MLL pertvarkymai)
Ankstyvieji ar keli recidyvai
Kondicionavimo schemos gali būti mieloabliacinis arba sumažėjęs intensyvumas. Transplantacija suteikia galimybę patirti transplantato ir leukemijos poveikį, tačiau sukelia transplantato ir šeimininko ligos riziką ir su gydymu susijusius mirtingumo pelenų klinikines naujienas HSCT.
4. Iš viso tikslinės terapijos
Tiksliniai agentai sukėlė revoliuciją visų valdymo, ypač atsparių ar recidyvo nustatymų.
4.1 Tirozino kinazės inhibitoriai (TKIS)
TKIS, nukreiptas į BCR-ABL1 (pvz., Imatinibą, dasatinibą, ponatinibą), yra labai svarbūs PH+ visiems, gerinant išgyvenamumą, kai jis derinamas su chemoterapija ar transplantacija NIH klinikiniais TKI tyrimais.
4.2 inotuzumabo ozogamicinas
Šis antikūnų ir vaistų konjugatas nukreiptas į CD22, išreikštą B-ląstelių visais pūtimais, selektyviai pateikdamas citotoksinį naudingą krovinį (kalicheamicin) į leukemines ląsteles. Tai parodė recidyvo/atsparios B-All FDA inotuzumab ozogamicino etiketės efektyvumą.
5. Imunoterapija: automobilių T-ląstelės ir bispecifiniai antikūnai
Imunoterapija keičia visą gydymą, pasinaudodama paciento imunine sistema, kad selektyviai nukreiptų į leukemines ląsteles.
5.1 Chimerinis antigeno receptorius (CAR) T-ląstelių terapija
Automobilių T ląstelės yra genetiškai sukurtos taip, kad būtų išreikšti receptoriai, nukreipti į CD19 ant B-all pūtimų, nukreipdami T ląsteles, kad atpažintumėte ir nužudytumėte leukemiją. FDA patvirtintas automobilio T terapija, pavyzdžiui, isagenlecleucel parodė nepaprastą recidyvo/atsparios B-All FDA isagenlecleucel patvirtinimo veiksmingumą.
5.2 bispecifiniai antikūnai
Bispecifiniai antikūnai (BSAB) atspindi naują imunoterapinę klasę, kuri tuo pačiu metu suriša du skirtingus antigenus, paprastai vieną ant leukeminių sprogimų, o kitą – imuninės efektorinėse ląstelėse. Šis dvigubas nukreipimas skatina citolitinės sinapsės susidarymą, dėl kurio gali būti efektyvus naviko ląstelių žudymas.
Archetipinis BSAB visame gydyme yra Blinatumomabas (Blincyto):
Mechanizmas: Blinatumomabas yra bispecifinis T-ląstelių įtraukimo (įkandimo) antikūnas, surišantis CD19 ant B ląstelių pūtimų ir CD3 citotoksinių T limfocitų (CTL). Fiziškai sujungdamas T ląstelę ir naviko ląsteles, jis suaktyvina T ląsteles nepriklausomai nuo pagrindinio histokompatibilumo komplekso (MHC) atpažinimo, todėl tikslinės ląstelių apoptozės FDA bllinatumomabo etiketė.
Klinikinis naudojimas: Blinatumomabas yra FDA patvirtintas MRD teigiamam ir recidyvuojančiam/atspindinčiam B-All. Tai pasiekia visišką remisiją didelei daliai pacientų, įskaitant tuos, kurie turi nepageidaujamą riziką.
Privalumai: Blinatumomabas siūlo ne chemoterapiją, kuri panaudoja endogeninius imuninius efektorius ir gali būti tiltas į allo-HSCT.
Apribojimai: Toksiškumas, toks kaip citokinų išsiskyrimo sindromas (CRS) ir neurotoksiškumas, reikalauja stacionarinio stebėjimo, ypač pradinių ciklų metu.
Vykstantys klinikiniai tyrimai: Tyrimai tiria derinius su chemoterapija ar kitomis imunoterapijomis, siekiant padidinti efektyvumą ir sumažinti atkryčio klinikinę analizę.gov bllinatumomabo tyrimai.
Kiti tiriami bispecifiniai antikūnai apima tuos, kurie nukreipia CD22 arba CD20, kurie gali būti susiję su antigeno pabėgimu, matomu naudojant CD19 nukreiptą gydymą.
6. Atskleista ir atsparūs visi: iššūkiai ir naujovės
Nepaisant pažangos, atkrytis atsiranda 20–30% suaugusiųjų visų atvejų ir išlieka pagrindinė gydymo nesėkmės priežastis. Recidyvus visi yra atsparesni, dažnai reikalaujant gelbėjimo schemų, turinčių:
Alternatyvūs chemoterapijos protokolai
Blinatumomabas arba inotuzumabas
Automobilių T-ląstelių terapija
Nauji vaistai, atliekantys klinikinius tyrimus (pvz., Menino inhibitoriai, nukreipti
MRD stebėjimo integracija Gydymo adaptacija.
7. Palaikomoji priežiūra ir toksiškumo valdymas
Optimalus valdymas apima budrią palaikomąją priežiūrą, siekiant sušvelninti chemoterapijos sukeltą mielosupresiją, infekcijas, naviko lizės sindromą ir toksiškumą organams. Tai apima antimikrobinę profilaktiką, perpylimo palaikymą, augimo faktorius ir simptomų valdymą.
8. Ilgalaikiai rezultatai ir išgyvenimas
Visų vaikų gydymo procentas viršija 80%, tai yra daugiadalykio gydymo triumfas. Suaugusiųjų rezultatai išlieka ne tokie palankūs, tačiau tobulėja naudojant riziką pritaikytus metodus.
Ilgalaikiams išgyvenusiems žmonėms reikia stebėti pavėluotą efektą, įskaitant:
Išgyvenimo programos, nagrinėjančios šias problemas, yra gyvybiškai svarbios leukemijos ir limfomos visuomenės išgyvenimo informacija.
9. Ateities visos terapijos perspektyvos
Vykdomi tyrimai siekiama patobulinti molekulinę diagnostiką, pagilinti leukemijos biologijos supratimą ir sukurti naujos kartos terapiją, įskaitant:
Daugianažka, nukreipta į bispecifinius antikūnus
Patobulintos automobilių T-ląstelių platformos, kurių patobulintas patvarumas ir sumažintas toksiškumas
Mažos molekulės inhibitoriai prieš epigenetinius ir signalizacijos kelius
Imuninės kontrolės taško blokada Pasirinkite visus potipius
Vienos ląstelės daugialypė omika, apibūdinanti leukemijos heterogeniškumą ir atsparumą terapijai
Mikrobiomo moduliacija ir naviko mikroaplinkos taikymas
Šie pasiekimai žada dar labiau pagerinti gydymo procentus ir gyvenimo kokybę.
Visų gydymas įkūnija sudėtingą, daugiapakopį metodą, integruojantį intensyvią chemoterapiją, CNS režisuotą terapiją, tikslinius agentus, imunoterapiją, įskaitant bispecifinius antikūnus ir kamieninių ląstelių transplantaciją. Tikslioji medicina, kurią lemia molekulinio profiliavimas ir MRD įvertinimas, suteikia galimybę pritaikyti riziką, pritaikytą atskirai pacientų biologijai.
Bispecifiniai antikūnai, tokie kaip blinatumomabas, yra imuniteto reagavimo terapijos etapas, revoliucinis gydymas, ypač dėl recidyvo ar MRD teigiamos ligos. Besivystantis terapinis kraštovaizdis žada ir toliau tobulėti, o tai skatina transliacijos tyrimai ir novatoriški klinikiniai tyrimai, suteikiantys vilties išgydyti visas visas pacientų populiacijas.
Nuorodos ir tolesnis skaitymas: